A depressão pós-parto (DPP) é um transtorno depressivo maior prevalente que ocorre em mulheres durante o período puerperal; representa a condição de saúde mental mais comum durante os períodos perinatal e pós-parto. A incidência global de DPP varia de 15% a 30%, 1 , 2 e na China aproximadamente 25% das novas mães podem ser propensas à DPP. 3 , 4 A depressão pós-parto é caracterizada por uma variedade de sintomas, incluindo mau humor, interesse reduzido em atividades, tristeza, irritabilidade, insônia, esgotamento, atenção diminuída e até mesmo tendências suicidas recorrentes. 5 Essas manifestações podem influenciar o bem-estar físico e psicológico das novas mães. Quatorze Comitês de Revisão de Mortalidade Materna dos EUA identificaram recentemente as condições de saúde mental materna como responsáveis por 68% das mortes relacionadas à gravidez, sendo a DPP o principal fator contribuinte. 6 Além disso, a DPP também pode afetar adversamente o comportamento, as emoções e o desenvolvimento cognitivo dos bebês. 7 – 10 Tais distúrbios podem representar um fardo adicional para a mãe e o recém-nascido, bem como para toda a família. Essas descobertas têm incentivado pesquisadores a buscar possíveis soluções para a DPP.
Há evidências convincentes que ligam o sistema glutamatérgico a transtornos depressivos, e a liberação excessiva de glutamato pode agravar lesões no circuito neural e comprometimento funcional na regulação do humor. Há uma correlação positiva entre concentrações de glutamato em regiões cerebrais cruciais e PPD em novas mães quando comparadas a controles. 11 , 12 Os receptores N- metil- d- aspartato (NMDA) foram implicados na desregulação do neurotransmissor glutamatérgico 13 , 14 ; esses receptores podem ser uma característica causal crítica de transtornos de humor. 15 , 16 A cetamina, um antagonista clássico não competitivo do receptor NMDA glutamatérgico, não só pode bloquear os receptores NMDA diretamente, mas também inibe a atividade do interneurônio ácido γ-aminobutírico-érgico e estimula a sinaptogênese, 17 , 18 permitindo que ela forneça efeitos antidepressivos, bem como atue como anestésico e analgésico. 19 Vários ensaios clínicos demonstraram que a cetamina proporciona ações antidepressivas rápidas e eficazes em pacientes com depressão. 20 – 22 Também foi demonstrado que ela tem um papel potencial no tratamento da DPP. 23
Recentemente, a escetamina, um novo antagonista do receptor NMDA com maior afinidade do que a cetamina, tem sido usada em vários países, incluindo a China. Como uma resolução dextral da cetamina, a escetamina demonstrou melhorar a eficácia de anestésicos e analgésicos, com um efeito antidepressivo semelhante ao seu antecessor. 24 , 25 Numerosos estudos descobriram que um spray nasal de escetamina poderia induzir e sustentar rapidamente efeitos benéficos para pacientes com diagnóstico de depressão resistente ao tratamento e risco de suicídios. 26-29 Estudos anteriores também descobriram que, para mulheres que passaram por partos cesáreos, uma administração preventiva de escetamina, seja pela via intratecal ou intravenosa, poderia produzir efeitos analgésicos seguros e eficazes. 30 , 31 Dada sua eficácia bidirecional como analgésico e antidepressivo, realizamos um ensaio clínico duplo-cego e randomizado para investigar os efeitos da administração adjuvante de escetamina perioperatória durante cesariana em pacientes com DPP.
Métodos
Desenho do Estudo
Este ensaio clínico prospectivo, duplo-cego, randomizado e controlado por placebo foi aprovado pelo Comitê de Ética Institucional do Hospital Provincial de Fujian e registrado no Registro Chinês de Ensaios Clínicos ( ChiCTR2100054199 ). O protocolo do ensaio e o plano de análise estatística são fornecidos no Suplemento 1. Os pacientes foram inscritos entre 1º de janeiro de 2022 e 1º de janeiro de 2023. Todos os participantes forneceram consentimento informado por escrito para participar deste estudo, que seguiu as diretrizes de relato dos Padrões Consolidados de Relato de Ensaios ( CONSORT ).
Foram incluídas gestantes de 18 a 40 anos, classificadas como ASA grau I a III pela Sociedade Americana de Anestesiologistas (ASA), com gestação única a termo (> 37 semanas). Elas foram programadas para cesáreas eletivas no Hospital Provincial de Fujian ou em sua filial sul. Foram excluídas aquelas com transtornos mentais pré-natais, hipertensão ou risco de hipertensão intracraniana, pré-eclâmpsia, eclâmpsia, hipertireoidismo, placenta prévia, descolamento prematuro da placenta e placenta acreta. Também foram excluídas aquelas com alergia a antagonistas dos receptores NMDA e incapacidade ou indisposição para cooperar com questionários e exames clínicos.
Os pacientes foram alocados aleatoriamente em uma proporção de 1:1 em dois grupos, o grupo escetamina e o grupo controle, utilizando uma tabela de randomização computadorizada. Antes da anestesia, o coordenador do estudo abriu os envelopes consecutivamente, de acordo com a sequência de recrutamento, e os medicamentos a serem usados para cada paciente foram preparados. Todos os pacientes, anestesiologistas, cirurgiões, entrevistadores de acompanhamento e pesquisadores envolvidos na coleta e análise de dados foram cegados quanto à cota de alocação de cada grupo durante todo o período do estudo (eFigura no Suplemento 2 ).
Anestesia Perioperatória e Manejo da Analgesia
Após a entrada do paciente na sala de cirurgia, um canal intravenoso foi estabelecido, e a oximetria de pulso, o eletrocardiograma e a pressão arterial não invasiva do paciente foram monitorados. O oxigênio foi fornecido a 2 L/min através de um cateter nasal. O paciente foi deitado em decúbito lateral esquerdo e uma agulha raquidiana foi perfurada no espaço subaracnóideo através do interespaço L2-L3 ou L3-L4. Em seguida, 12 mg de ropivacaína a 0,6% foram administrados. Após a retirada da agulha, um cateter epidural reforçado foi colocado 3 a 4 cm no espaço epidural; 5 mL de lidocaína a 2% foram então administrados através do cateter, que foi usado para avaliar o efeito do anestésico. O nível superior do bloqueio sensorial foi ajustado para entre os níveis T6 e T7. Enquanto monitorava quaisquer alterações na pressão arterial, se necessário, o paciente foi reposicionado em uma inclinação lateral esquerda de 30° e 6 a 12 mg de efedrina e soluções coloidais para estabilização hemodinâmica foram administrados por via intravenosa. Imediatamente após o parto, as pacientes do grupo escetamina receberam 0,25 mg/kg de escetamina e 2 mg de midazolam por via intravenosa, diluídos para um volume de 10 mL com solução salina a 0,9%. Nos pacientes do grupo controle, foi injetado volume igual de solução salina normal e 2 mg de midazolam. Em seguida, um dispositivo de analgesia intravenosa controlado pelo paciente foi utilizado para administrar uma mistura de 100 μg de sufentanil, 50 mg de escetamina e 0,25 mg de cloridrato de palonosetrona em 100 mL de solução salina. Para as pacientes do grupo controle, apenas 100 μg de sufentanil e 0,25 mg de cloridrato de palonosetrona em 100 mL de solução salina foram administrados por meio de uma bomba de analgesia intravenosa controlada pelo paciente. As bombas foram ajustadas para uma taxa de infusão de base de 2 mL/h por 48 horas. Foi administrada uma dose em bolus de 2 mL e um tempo de bloqueio de 10 minutos foi usado em ambos os grupos.
Medidas de Resultados
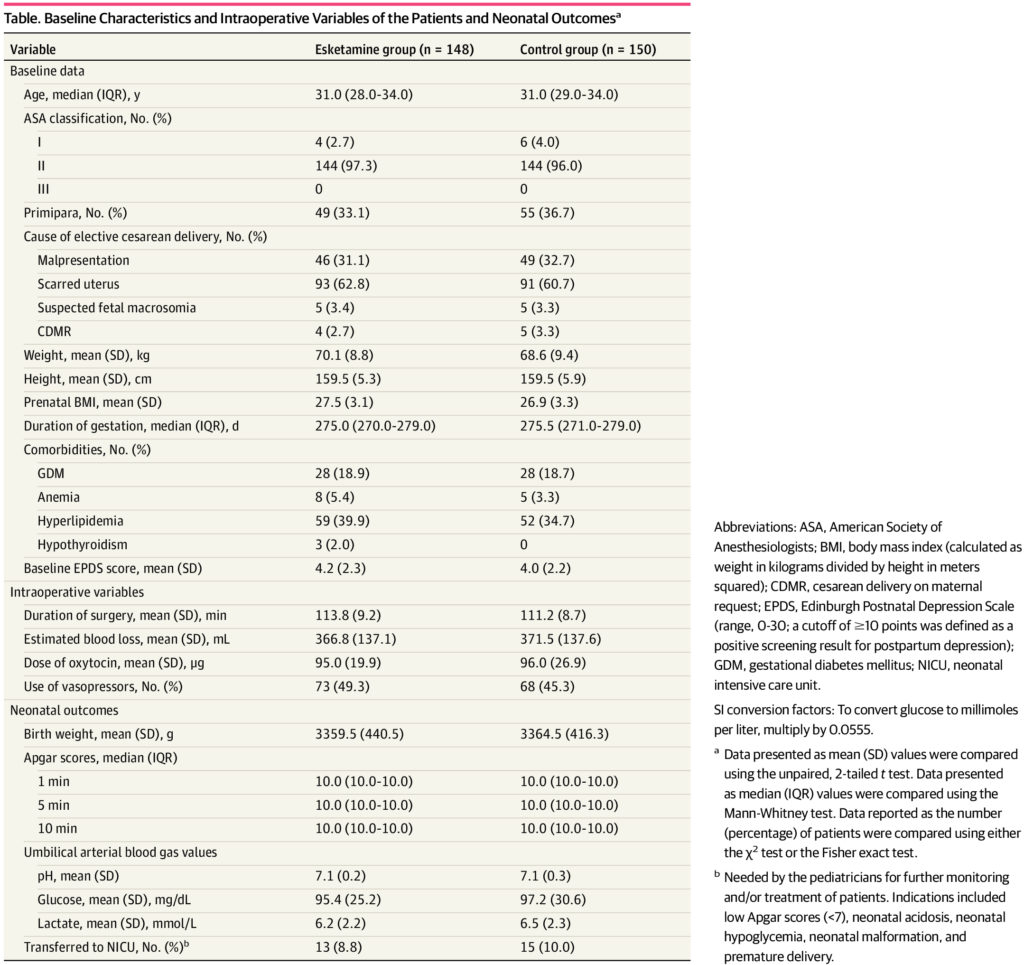
Os dados basais incluíram características demográficas, classificação ASA, número de partos, duração gestacional e comorbidades pré-gestacionais. Os dados intraoperatórios incluíram duração da cirurgia, sangramento intraoperatório e uso de vasopressores. Os dados neonatais incluíram peso do recém-nascido, escores de Apgar avaliados 1 e 5 minutos após o nascimento, valores de gasometria arterial umbilical e taxa de admissão na unidade de terapia intensiva neonatal.
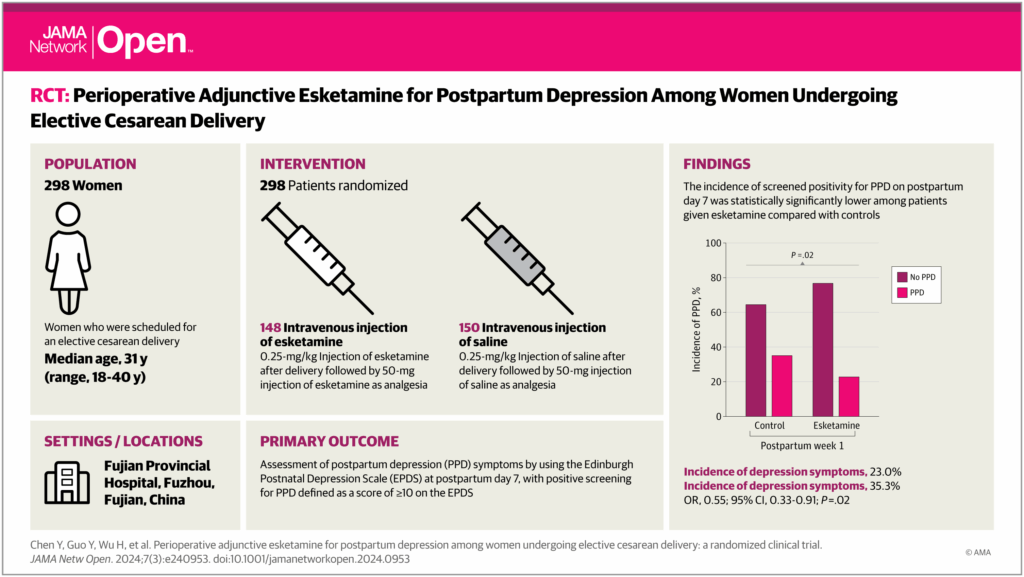
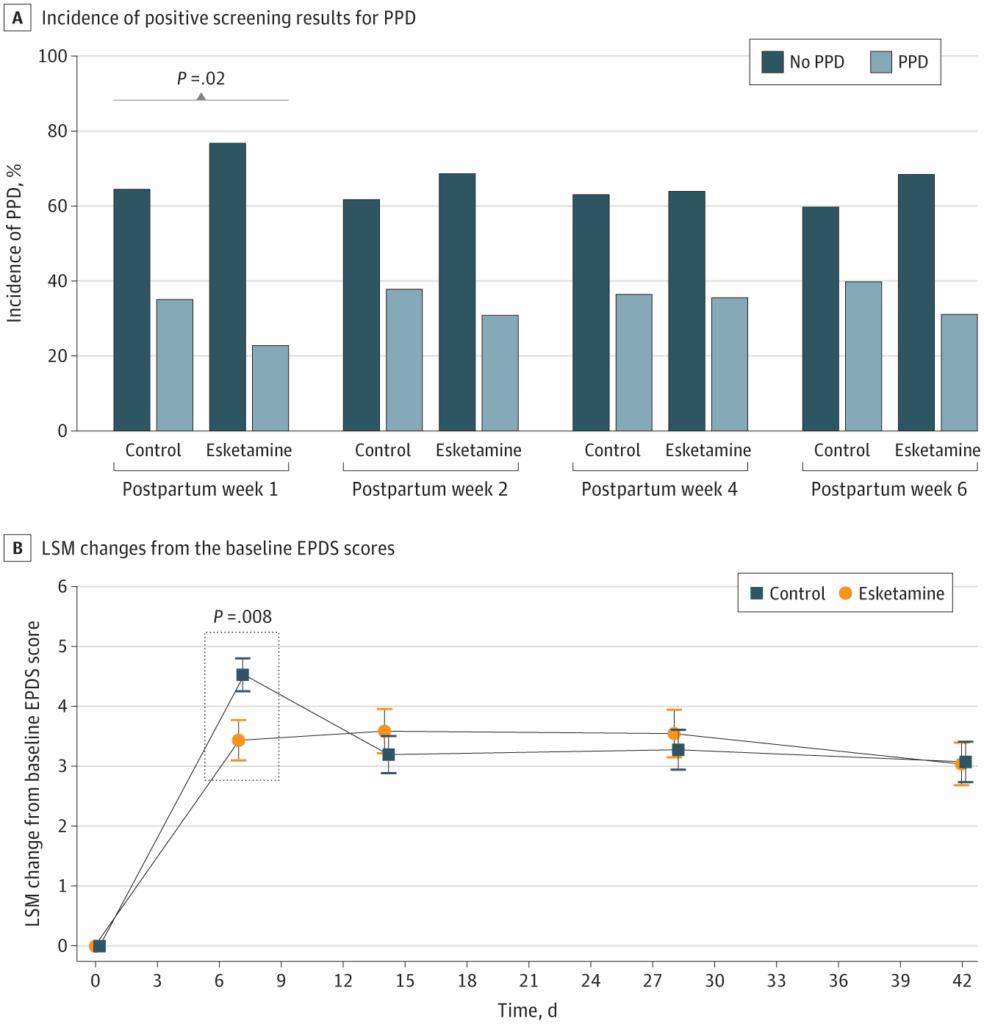
Nosso desfecho primário foi o autorrelato de sintomas depressivos pós-parto, que foram avaliados usando a Escala de Depressão Pós-Parto de Edimburgo (EPDS). 32 Essa escala é um teste de triagem de depressão pós-parto amplamente utilizado. 33 Ela consiste em 10 itens, cada um dos quais é pontuado em uma escala de 4 pontos (intervalo, 0-3). As pontuações totais da EPDS, que variaram de 0 a 30 pontos, foram a soma das pontuações de cada item. Para determinar a incidência de DPP, um ponto de corte de 10 ou mais pontos foi definido como positivo para DPP de acordo com as recomendações publicadas. 34 – 36 Além disso, para avaliar os sintomas depressivos entre as 2 coortes, também analisamos a pontuação da EPDS como uma variável contínua. Isso envolveu comparar a mudança neste parâmetro entre os 2 grupos da linha de base (no dia anterior à cirurgia) até os pontos finais. Nosso ponto final primário de eficácia foi definido no dia 7 pós-parto, e os pontos finais secundários de eficácia foram avaliados nos dias 14, 28 e 42 após o parto. A avaliação da escala foi realizada por um entrevistador treinado (TC) que não tinha conhecimento dos detalhes do protocolo e da alocação do grupo.
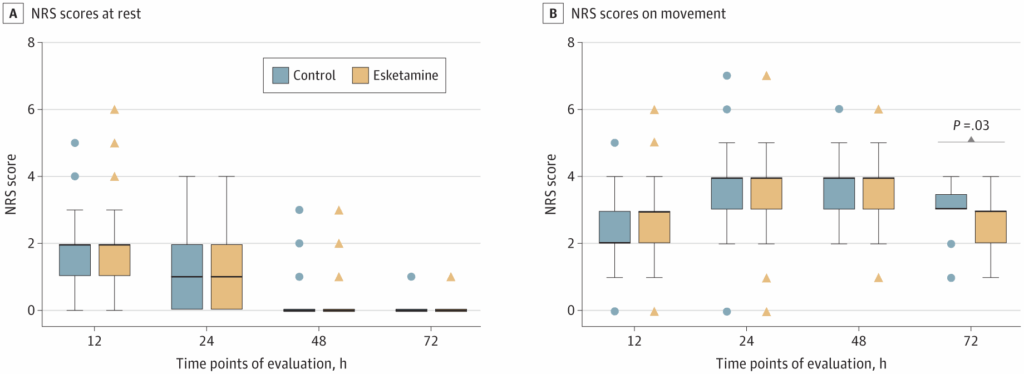
Nossos desfechos secundários incluíram a intensidade da dor materna em repouso, bem como durante os movimentos, e foram avaliados 12, 24, 48 e 72 horas após a cirurgia, além da sensibilidade à dor pós-parto no 7º dia pós-parto. A avaliação da intensidade da dor foi realizada utilizando a Escala Numérica de Avaliação (ENR), uma escala de 11 pontos que varia de 0 a 10, onde 0 representa ausência de dor e 10 representa a dor mais intensa. Além disso, a recuperação da função gastrointestinal pós-operatória foi estimada registrando-se os tempos até a primeira flatulência e a defecação. Também monitoramos todas as complicações pós-operatórias dentro de 3 dias da cirurgia, incluindo náuseas e vômitos, bem como sintomas neuropsiquiátricos (como nistagmo, tontura, dores de cabeça, pesadelos e alucinações).
Análise Estatística
O tamanho estimado da amostra foi calculado utilizando o software PASS, versão 15.0 (NCSS), com base em nosso estudo preliminar, no qual a incidência de positividade para DPP no 7º dia pós-parto foi de 35% para pacientes submetidas à cesariana. O tamanho do efeito esperado foi posteriormente calculado para detectar uma redução de 50% na prevalência de DPP após a cirurgia, com um α bilateral = 0,05 e poder de 90%. O tamanho da amostra foi determinado em 128 pacientes. Após perda de seguimento e retiradas do consentimento, 150 pacientes foram selecionadas para inclusão em cada braço deste estudo.
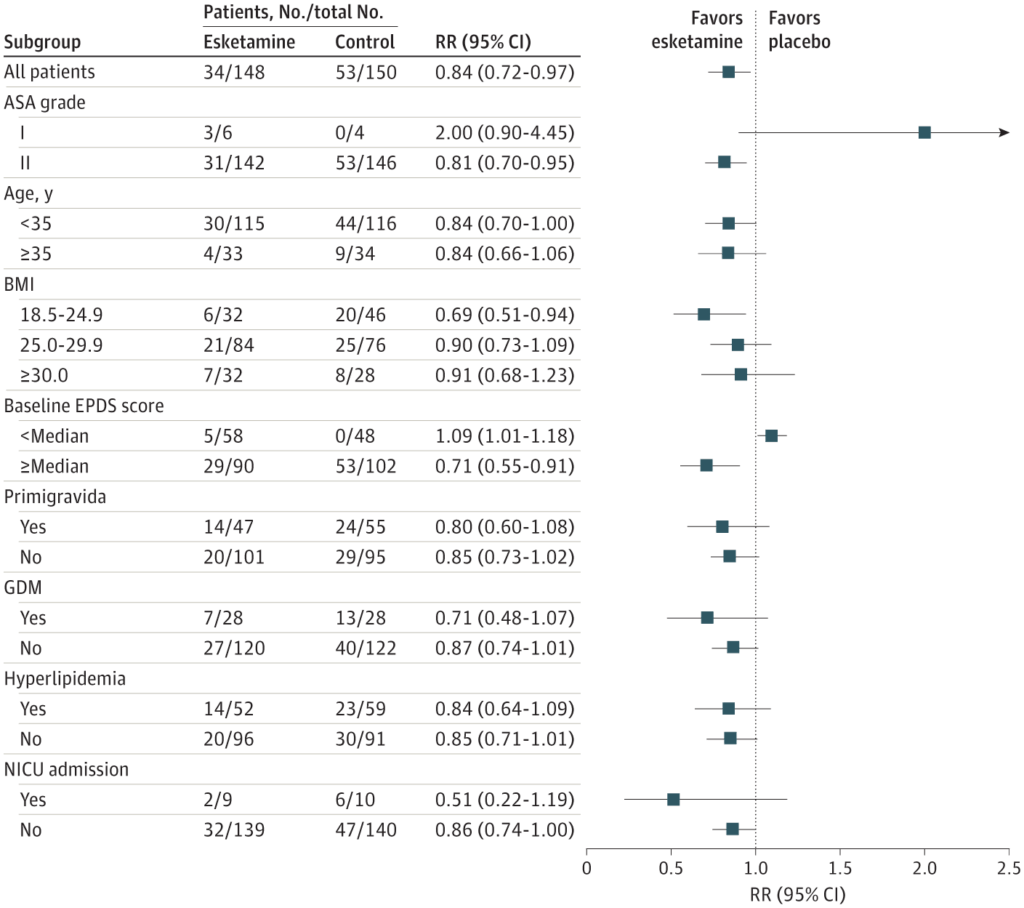
A análise estatística foi realizada usando o SPSS, versão 26.0 (IBM SPSS) e o software estatístico R, versão 4.2.0 (R Project for Statistical Computing). A normalidade das variáveis foi determinada usando o teste de Kolmogorov-Smirnov. Dados contínuos com distribuição normal foram apresentados como valores médios (DP), e as comparações intergrupos usaram o teste t bicaudal não pareado ou a análise de variância unidirecional. Variáveis com distribuição não normal foram apresentadas como valores medianos (IQR), e as comparações intergrupos foram determinadas usando o teste de Mann-Whitney. Porcentagens foram usadas para apresentar as variáveis categóricas; estas foram comparadas usando o teste χ2 ou o teste exato de Fisher. As mudanças nas pontuações EPDS em diferentes pontos de tempo entre os grupos foram analisadas com um modelo de efeito misto usando medidas repetidas. Este modelo incluiu a pontuação EPDS basal como covariável e o dia do tratamento, bem como as interações dia a dia do tratamento, como efeitos fixos. Interceptos aleatórios e estruturas de covariância não estruturadas foram usados para modelar os erros intrapacientes. Uma análise exploratória foi conduzida para avaliar as disparidades em nossos desfechos primários dentro dos subgrupos predeterminados. Os fatores de confusão de estratificação foram corrigidos usando o teste de Cochran-Mantel-Haenszel. As análises primárias foram realizadas por um conjunto de análise de intenção de tratar modificado, que incluiu todos os participantes aleatoriamente designados que receberam tratamento e tiveram pelo menos 1 avaliação de triagem de PPD. 37 Um P < 0,05 foi considerado estatisticamente significativo. Os achados para desfechos secundários e análises de subgrupos devem ser considerados exploratórios devido ao potencial de erros do tipo I resultantes de comparações múltiplas.
Resultados
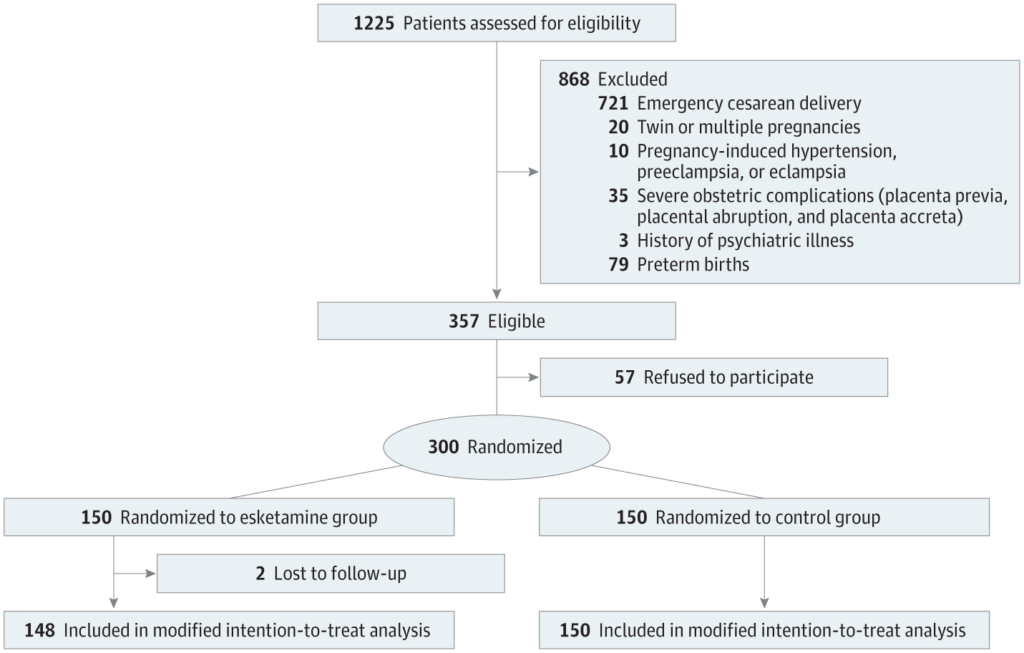
Um total de 1225 mulheres grávidas foram avaliadas para elegibilidade entre 1º de janeiro de 2022 e 1º de janeiro de 2023. Destas, 357 eram elegíveis, e 150 foram inscritas e aleatoriamente designadas para os grupos de escetamina e controle. Entre as pacientes inscritas, 2 mulheres recusaram o acompanhamento no 5º dia pós-parto, e 298 mulheres foram incluídas na análise de intenção de tratar modificada (148 no grupo de escetamina [idade mediana, 31,0 anos (IQR, 28,0-34,0 anos)] e 150 no grupo de controle [idade mediana, 31,0 anos (IQR, 29,0-34,0 anos)]; Figura 1 ). As características basais, os dados intraoperatórios e os resultados neonatais foram bem equilibrados entre os 2 grupos ( Tabela ). A maioria dos pacientes foi classificada como ASA classe II (grupo escetamina, 97,3% [144 de 148]; grupo controle, 96,0% [144 de 150]) e multíparas (grupo escetamina, 66,9% [99 de 148]; grupo controle, 63,3% [95 de 150]). As pontuações EPDS basais médias (DP) foram 4,2 (2,3) e 4,0 (2,2) nos grupos escetamina e controle, respectivamente.